醫藥產品捷報頻傳!復宏漢霖股價喜迎5連漲
2月7日,復宏漢霖(02696.HK)延續近期漲勢,截至收盤,該股漲幅為8.38%,報20.05港元/股,成功錄得5連漲,區間累計漲幅約19.63%。
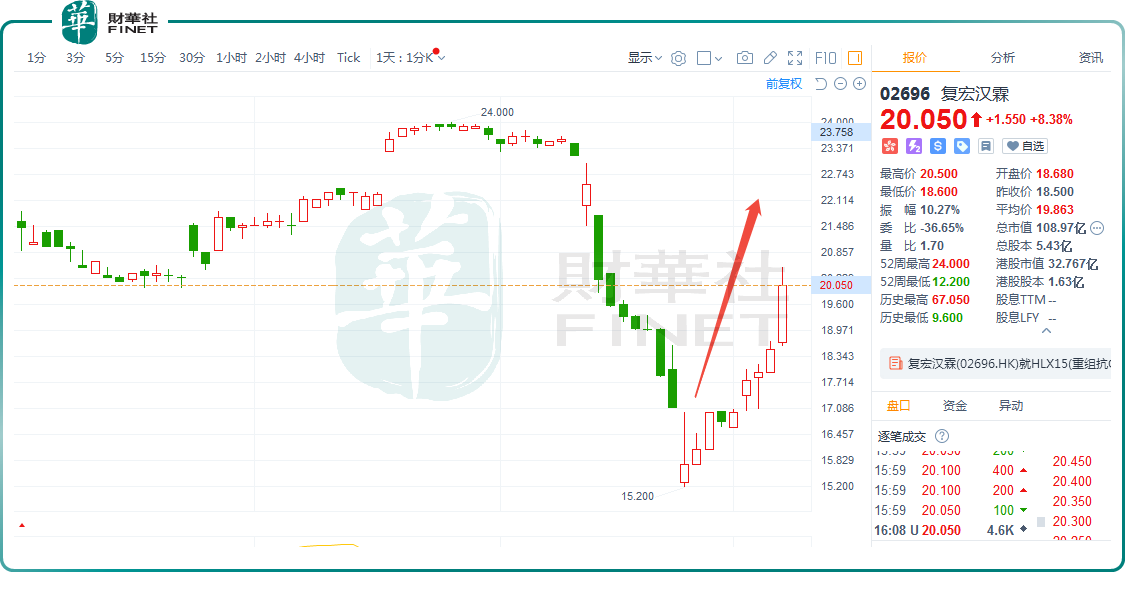
從消息面來看,復宏漢霖此輪漲幅,主要得益於公司產品最新進展消息的疊加催化效應。
2月2日,復宏漢霖發佈公告稱,近日,公司自主研發的Perjeta (帕妥珠單抗)生物類似藥候選藥HLX11(重組抗HER2結構域Ⅱ人源化單克隆抗體注射液)(HLX11)的生物制品許可申請(BLA)獲美國食品藥品管理局(FDA)受理。
據悉,HLX11是公司自主研發的帕妥珠單抗生物類似藥,擬用於HER2陽性早期乳腺癌的新輔助/輔助治療、HER2陽性轉移性乳腺癌的治療及與原研藥藥品標簽相符的其他適應症。
緊接著,2月5日,復宏漢霖又傳來喜訊。歐盟委員會已批準其自主研發的抗PD-1單抗斯魯利單抗注射液(中國境内商品名:漢斯狀)聯合卡鉑和依託泊苷適用於廣泛期小細胞肺癌成人患者的一線治療。
漢斯狀在歐盟獲批上市,將成為公司繼曲妥珠單抗(中國境内商品名:漢曲優)之後,第二個在歐盟獲批上市的產品,也成為歐盟首個批準用於廣泛期小細胞肺癌治療的抗PD-1單抗藥品。復宏漢霖稱,這意味著國際主流市場對漢斯狀的認可,也將進一步提升公司產品的國際影響力。
2月6日,復宏漢霖再度發佈公告稱,與Dr. Reddy’s Laboratories SA("Dr.Reddy’s")訂立一份許可協議,據此,公司向Dr.Reddy’s授出一項許可,供其於美國及約定的歐洲地區内及領域内開發、生產和商業化HLX15(重組抗CD38全人單克隆抗體注射液)的靜脈注射制劑與皮下注射制劑。
HLX15是公司自主研發的達雷妥尤單抗生物類似藥,計劃用於治療多發性骨髓瘤。該產品已於2024年6月在中國境内(不包括港澳台地區)成功完成1期臨床研究。
復宏漢霖表示,本次與Dr. Reddy’s訂立許可協議有助於深化公司產品的出海進程,進一步提升公司產品在國際市場的可及性和影響力。
作為國内生物類似藥領域的領軍企業,復宏漢霖自2019年成功開發上市國内第一款生物類似藥「漢利康」以來,其產品商業化進展一直十分順利。
截至目前,復宏漢霖已有6款產品在中國獲批上市,4款產品在國際市場上獲批上市。此外,公司還擁有多個處於臨床Ⅲ期的項目,商業化前景明朗。
業界人士指出,憑借其多元的產品組合和現有的商業化優勢,復宏漢霖正在不斷推進已商業化產品的適應症拓展及市場拓展。漢曲優、漢斯狀、漢貝泰等已實現商業化的產品,其商業價值尚未完全釋放,未來的增長前景仍然可觀。






